Съдържание
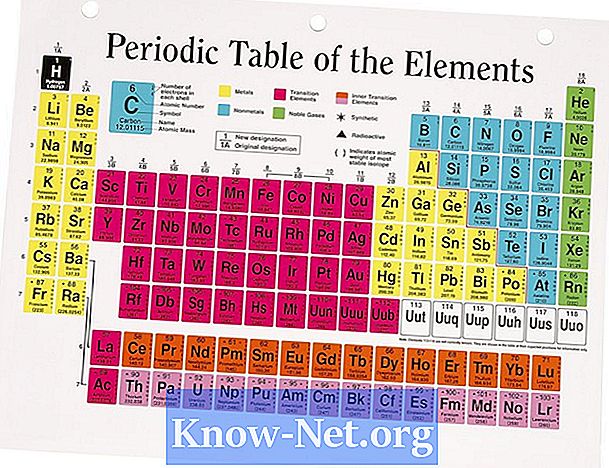
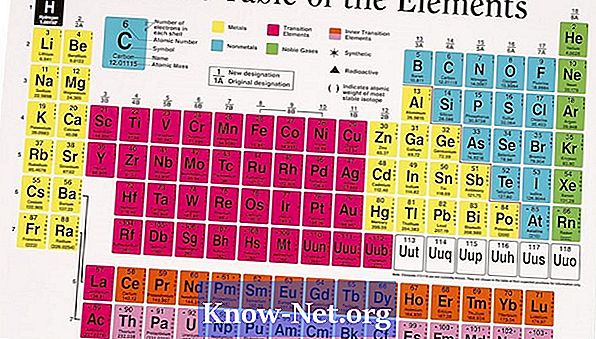
Повечето от елементите съществуват в природата под формата на повече от един изотоп. Изобилието от естествени изотопи влияе върху средната атомна маса на елемента. Атомната маса, която се намира в периодичната таблица, е средната стойност на стойностите на различните изотопи, които отчитат изобилието на всяка от тях. За елементи, които имат само един изотоп, атомната маса е близка до очакваната стойност въз основа на броя на протоните и неутроните в ядрото.
инструкции
-
Вижте възможния изотоп на интересуващия ни елемент. Всички елементи имат минимум изотоп. За да изчислим средната атомна маса, трябва да знаем колко са изотопите, тяхното изобилие и техните атомни маси.
-
Намерете естественото изобилие на всеки изотоп и отбележете тези стойности с изотопния номер на елемента.
-
Изчислете атомната маса, като използвате среднопретеглената стойност. Умножете всеки изотоп с процентното си изобилие и добавете всички стойности. Например, магнезият има три изотопа: Mg (24), Mg (25) и Mg (26), чиито проценти са 78.9%, 10% и 11.1% и чиито маси са 23,985, 24,986 и 25,983, съответно. Претеглената средна стойност се изчислява по формулата (процент 1 х атомна маса) + (процент 2 х атомна маса) + (процент 3 х атомна маса) = (0,789 х 23,885) + (0,1 х 24,986) + (0,111 х 25,983) = 18,924 + 2,499 + 2,884 = 24,307. Публикуваната стойност е 24,305. Закръгляването на стойностите оправдава малката разлика.
Какво ви трябва
- Изотопи на елемента
- Процентно изобилие


